Я так думаю, что стоит по ним чуток пробежаться. Это не так сложно, но позволяет понимать структурные формулы, которые часто приводятся в описаниях.
Нашла очень хорошую ссылочку на примитивное объяснение терминов в химии.
Решила, что ей самое место в начале темы.
Нам нужно разобраться сначала в базовых элементах органической химии - углероде, водороде, кислороде.
Вообщем, начнем сначала - с таблици Менделеева:

Она представлена периодами ( горизонтальными) и группами ( вертикальными).
У каждого элемента есть номер, который примерно соответствует атомной массе.
В таблице только атомы представлены, не молекулы. Молекула может состоять из нескольких атомов.
Простейший - водород. Имеет один электрон - отрицательно заряженный. В целом атом нейтрален за счет того, что у него ядро положительное. В ядре содержатся и положительные - протоны и нейтральные частицы.
Итак, ядро - положительное, электрон отрицательный. По идее должен электрон прилипнуть к ядру. Нет, не прилипает, потому что движется с офигительное скоростью. Это тоже можно обосновать, разложить по силам и окончательно запудрить вам мозги, но не буду.
Как удается сохранить в атоме относительный покой и порядок?
Оказывается, электроны в ядре располагаются не как попало, а слоями - энергетическими уровнями. Эти уровни, как этажи в доме - первый, второй, третий и так далее. Это есть периоды (горизонтальные).
Но вот количество атомов на каждом уровне ( периоде ) уже можно узнать по группе.
Вообщем, водород - простейший элемент стоит в первой групп, значит, у него только один электрон вращается. Дальше в том же периоде гелий. У него два электрона.
Все. Первый период закончился.
Дальше второй. Третий электрон у лития идет уже на следующий уровень.
Электронные облака - траектории имеют определенную форму.
Сферическую атомную орбиталь ученые договорились называть s-орбиталью. Она самая устойчивая и располагается довольно близко к ядру или спином 
Их ( спина) по два на каждом уровне и они находятся в самом начале. У первых двух атомов в периоде на внешнем уровне начинают появляться именно спины.
Получается, что у водорода - один спин, у гелия два спина, которые движутся в разных направлениях, чтобы не столкнуться.
У лития два спина на первом уровне и один на втором, дальше у бериллия по два спина на двух уровнях.
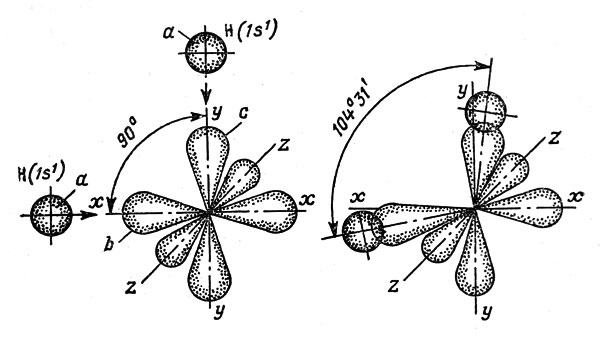
А вот у бора появляется уже дргое электронное облако.
Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания и наконец превращается в гантелеобразную p-орбиталь 
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. Это легко объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга. 
Вот дальше накопление электронов идет по этим орбиталям. Снаячала заполняются по одному каждая орбиталь, затем еще по одному - в противоположную сторону.
Итак три периода, просто на каждом свои уровни, а формы орбиталей электронов вот такие одинаковые, в соответствии с группами.
Дальше появятся другие формы облаков, появляются еще предвнешние уровни, но оно нам не нужно. Это уже больше металлов касается.
А углерод, водород, кислород укладываются в эту информацию.
Пока хватит, потом продолжу. Кому интересно могут здесь почитать.
Вот так вот! А вы что думали! Игрушки что ли играть! Все в ликбез!
Отредактировано Левзея (16.01.2009 16:17:18)

 ты рассказываешь гораздо интереснее, чем написано в учебнике! А главное - понятнее!
ты рассказываешь гораздо интереснее, чем написано в учебнике! А главное - понятнее!
 или вот так лучше видно:
или вот так лучше видно:
 .
.









 - здесь изображение в структурном виде карбонильной группы.
- здесь изображение в структурном виде карбонильной группы. - здесь она прицепляется к последнему атому в углеродном скелете.
- здесь она прицепляется к последнему атому в углеродном скелете. - здесь в середине углеродного скелета.
- здесь в середине углеродного скелета.


